Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Le système immunitaire adaptatif des vertébrés a deux caractéristiques. Premièrement, la capacité de créer, par recombinaison somatique orchestrée par la protéine RAG (Recombination-activating gene), l'incroyable diversité des anticorps et de récepteurs T. Deuxièmement il est caractérisé par le très grand polymorphisme des gènes du complexe majeur d'histocompatibilité appelés HLA chez l'Humain. Les scientifiques montrent ici que la domestication du transposon RAG a été un événement majeur dans la mise en place de ces deux caractéristiques de notre système immunitaire.
Dans cet article les chercheurs proposent plusieurs hypothèses qui, ensemble, peuvent expliquer l'émergence du système immunitaire adaptatif spécifique des vertébré à mâchoire.
© Pierre Pontarotti.
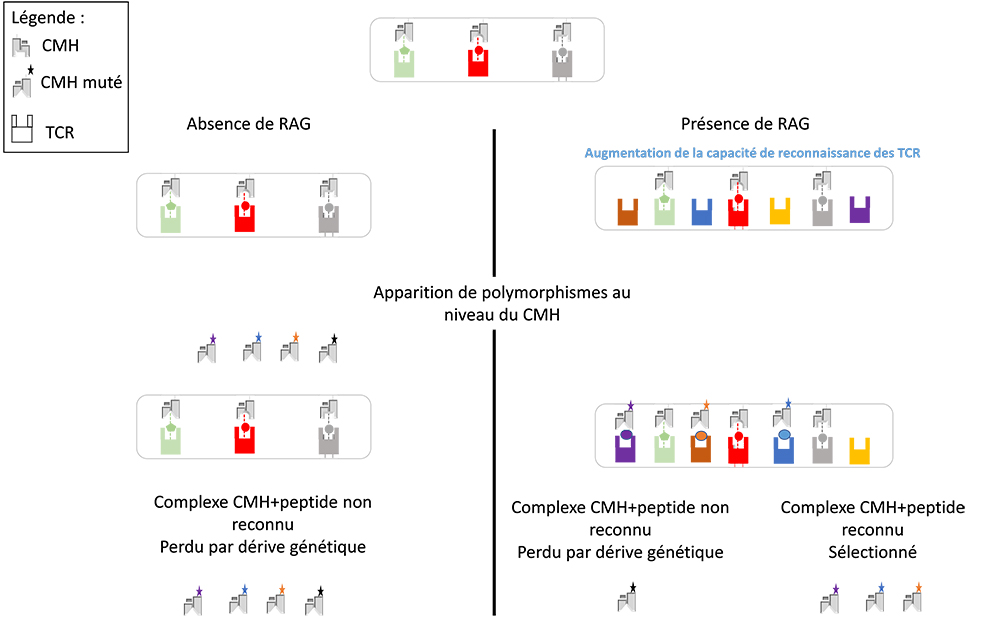
Figure: La diversité somatique des récepteurs cellules T (TCR) pourrait conduire à l'apparition du polymorphisme du CMH. Chaque molécule ancestrale de type TCR ne peut alors reconnaître qu'une classe particulière de complexe CMH ancestral + peptide. Une mutation dans la molécule de type CMH ancestrale peut avoir permis la liaison d'un nouveau peptide, mais si cette nouvelle combinaison n'est pas reconnue par la molécule de type TCR, ces mutations ne seront pas sélectionnée (Dérive génétique). A l'inverse, l'intégration du transposon RAG dans un gène de type TCR ancestral conduit à une probabilité significativement accrue de reconnaissance par ces TCR. En conséquence, les molécules du CMH mutées auraient pu ensuite être reconnues par divers TCR par la suite, devenant évolutivement sélectionnées et conduit à la mise en place du polymorphisme.
Le système immunitaire des vertébrés est basé, en particulier, sur l'interaction entre les anticorps, le récepteur des cellules T et les protéines du complexe majeur d'histocompatibilité (CMH, HLA chez l'Humain). Les anticorps et récepteurs des cellules T sont générés durant le développement des cellules B et T par recombinaison somatique via un réarrangement des modules V D et J. Ce processus de recombinaison explique en grande partie l'incroyable diversité des anticorps et des récepteurs T. Ce processus de recombinaison est orchestré par les protéines RAG (Recombination-activating gene). Les protéines du CMH sont les plus polymorphiques de toutes les protéines des vertébrés et interagissent en particulier avec des fragments de pathogènes qui vont être présentés aux cellules T via leur récepteur et ainsi initier la réponse immune adaptative.
Un système immunitaire inné complexe peut-il avoir existé bien avant l'émergence de l'ancêtre vertébré, y compris de grandes familles multigéniques capables de reconnaître des agents pathogènes étrangers ? RAG a pour origine un transposon. Les transposons sont classiquement décrits comme des éléments génétiques "égoïstes" et utilisent l'organisme hôte pour leur réplication. C'est le cas pour RAG qui était actif dans les organismes de l'ancêtre des animaux bilatériens, et encore actif chez certains animaux (amphioxus, certains hémichordés...). Ce transposon a donc été "domestiqué" chez l'ancêtre des vertébrés à mâchoire. Le passage de l'activité insertion/excision à la recombinaison séquence-spécifique de RAG serait donc un simple changement fonctionnel. Ces propriétés auraient augmenté la probabilité de cooptation du transposon RAG en tant qu'acteur majeur modulant la diversité somatique des anticorps et des récepteurs des cellules T.
Les scientifiques proposent également que que les molécules ancestrales du CMH interagissaient avec des motifs moléculaires associés aux pathogènes et les présentaient aux molécules ancestrales des récepteurs T, ce système étant intégré dans le système immunitaire inné des ancêtres des vertébrés Dans ce cadre, si une mutation survient dans l'un des gènes du pré-CMH, lui donnant la possibilité de reconnaître un nouveau motif moléculaire, celle-ci ne sera pas fixée et donc perdue par dérive génétique car le TCR (récepteur des cellules T) ancestral ne reconnaîtrait pas cette nouvelle combinaison. La domestication du transposon RAG conduisant à l'augmentation de la capacité de reconnaissance des récepteurs T aurait permis à ces mutations reconnaissant de nouveaux motifs moléculaires d'être sélectionnées, accroissant ainsi la capacité de reconnaissance des protéines du CMH et leur diversité génétique.
Cette hypothèse permet d'expliquer l'origine de polymorphisme du CMH et le maintien de ce dernier dans les espèces actuelles.
Pour en savoir plus:
Origins of the RAG transposome and the MHC
Tsakou-Ngouafo L, Paganini J, Kaufman J, Pontarotti P.
Trends in Immunology 25 mai 2020. DOI: https://doi.org/10.1016/j.it.2020.05.002
Laboratoire:
Microbes Evolution Phylogeny and Infections(MEPHI) - (Aix Marseille Univ/IRD/APHM)
19-21 Boulevard Jean Moulin 13005 Marseille.
Contact:
Pierre Pontarotti - Directeur de recherches CNRS au Microbes Evolution Phylogeny and Infections (MEPHI)
Populaires